|
Verfahren zur Herstellung von Methanol getestet
Ich habe diese Woche das Verfahren von Hr. Bandi getestet.
Das Patent beschreibt ein Verfahren, wie man aus Kohlendioxid und Wasser eine Umwandlung zu Methanol erreicht.
Im Prinzip wird flüssiges Kohlendioxid und Wasser in einer Druckkammer gemischt und einer Elektrolyse unterzogen.
Die Elektroden sind ummantelt mit Titandioxid und oder Ruthenimoxid.
Es wird eine Umwandlung von bis zu 100 Prozent in Methanol erwartet.
Nach der Erläuterung scheint das Verfahren recht einfach zu sein.
Doch egal wie ich es anstelle, es entsteht nicht im Geringsten auch nur ein Bruchteil von Methanol.
Leider konnte ich nicht die exakten Elektroden reproduzieren und auch nicht die gleichen Verfahrensaufbauten.
Aber was mich verwundert hat, ist der Punkt, dass überhaupt kein Methanol entstand. Noch nicht mal Kleinstmengen
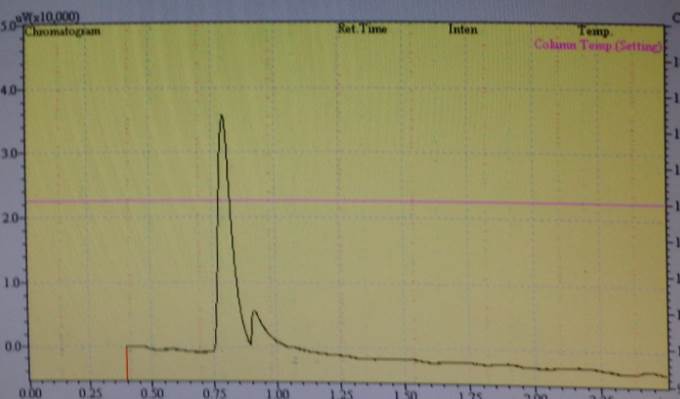
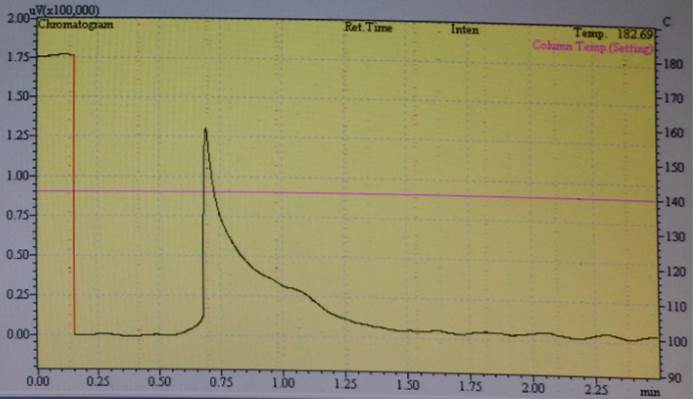
Die Ergebnisse wurden mit einem Gaschromatograph Shimadzu 14B überprüft.
Es konnte aber kein Nachweis erbracht werden, dass mit dem ersten Aufbau eine Umwandlung durchgeführt werden kann.
Ich habe mich schon gefragt, wo die ganzen Folgeprojekte geblieben sind, die aus dem obigen Patent herrühren könnten.
Doch leider habe ich in der Praxis noch kein Verfahren entdeckt, das hierraus etwas ableitet.
Elektrolyseverfahren und -vorrichtung zur Synthese von kohlenwasserstoffverbindungen mittels CO2-Umwandlung
Es ist online verfügbar unter
https://register.dpma.de/DPMAregister/pat/PatSchrifteneinsicht?docId=DE4126349A1
DE 4126349 A1
  Das Patent liegt vor unter
Das Patent liegt vor unter
 Das Patent wird wie folgt beschrieben im Aufbau
Das Patent wird wie folgt beschrieben im Aufbau
Eine bevorzugte Ausführungsform der Erfindung ist in den Zeich nungen dargestellt und wird nachfolgend beschrieben.
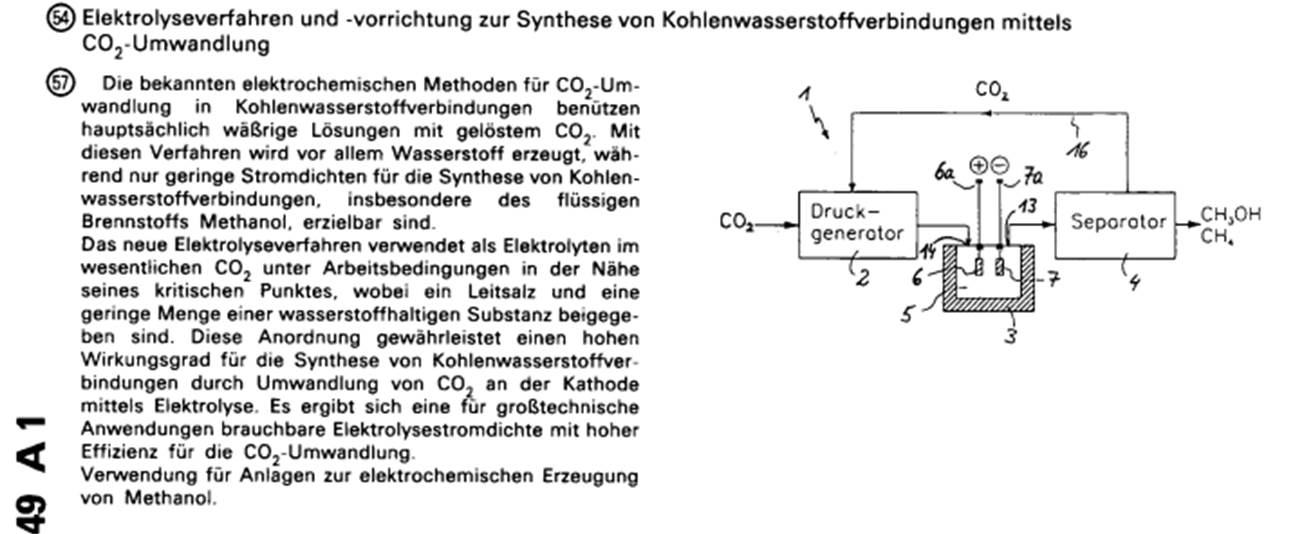
Fig.1 zeigt schematisch eine Anlage zur Durchführung einer Elektrolyse mit CO2im superkritischen Bereich als wesentlichen Elektrolytbestandteil,
Fig.2 das Druck/Temperatur-Phasendiagramm von CO2und
Fig.3 einen Längsschnitt durch eine Elektrolysezelle, wie sie für die Anlage nachFig.1 verwendbar ist.
Die inFig.1 dargestellte Elektrolyseanlage (1) besteht im Wesentlichen aus einem Druckgenerator (2), einer Elektrolyse zelle (3) und einem Separator (4). Der Druckgenerator (2) komprimiert das zugeführte gasförmige Kohlendioxid und führt dieses unter vorgegebenem Druck stehende CO2einer Reaktions kammer (5) innerhalb der Elektrolysezelle (3) zu. Die auf einer vorgegebenen Temperatur gehaltene Reaktionskammer (5) enthält den Elektrolyten, der im Wesentlichen aus CO2besteht. Druck und Temperatur sind innerhalb der Reaktionskammer (5) so festgelegt, daß sich der Elektrolyt im superkritischen Bereich oder in einem flüssigen Zustand nahe des superkritischen Bereiches befindet.
Dieser superkritische Bereich einer Substanz schließt sich, wie dies inFig.2 anhand des Phasendiagramms für reines CO2ge zeigt ist, an den sogenannten kritischen Punkt an, oberhalb dessen eine klare Trennung von gasförmigem und flüssigem Zustand der Substanz nicht mehr gegeben ist und die Substanz mit wachsendem Abstand von diesem kritischen Punkt einem idealen Gas immer ähnlicher wird. Dem Kohlendioxid ist Wasser in einer Konzentration von ca. 0,035 mol/Liter, der Löslich keitsgrenze unter diesen Bedingungen, beigegeben. Dadurch wird der kritische Punkt gegenüber demjenigen von reinem CO2gering fügig verschoben. Der kritische Druck des Elektrolyten liegt bei 74 bar, die kritische Temperatur bei 31,5°C. Druck und Temperatur innerhalb der Reaktionskammer werden bevorzugt während der Elektrolyse dicht oberhalb dieser kritischen Werte des Elektrolyten eingestellt.
Zu diesem Zweck muß die Elektrolysezelle ausreichend überdruck sicher aufgebaut sein. InFig.3 ist eine Elektrolysezelle (3) dargestellt, wie sie in der inFig.1 nur schematisch darge stellten Anlage verwendbar ist. Sie enthält einen druckfesten Zellenkörper (8) aus rostfreiem Stahl, der die Reaktionskammer (5) umgibt. Dieser Zellenkörper (8) ist seinerseits von einem Flüssigkeitsmantel (9) umgeben, mit dem der Zellenkörper (8) und damit die Reaktionskammer (5) auf der vorgegebenen Arbeits temperatur gehalten werden. Hierzu wird das im Flüssigkeits mantel (9) befindliches Medium, z. B. Wasser, auf die gewünschte Temperatur beheizt, wobei zur Regelung der Heizleistung die in der Reaktionskammer (5) herrschende Temperatur mit einer durch den Mantel (9) und den Zellenkörper (8) hindurchgeführten Temperatursonde (10) erfaßt wird. An einer Seitenwand des Zellenkörpers (8) ist zudem ein Fenster (11) angeordnet, durch das die Reaktionskammer (5) optisch überwachbar ist. In derselben Seitenwandung ist in der Nähe der Reaktionskammerober seite ein Auslaß (12) gebildet, der zu einem Gaschromatograph führt, mittels dem die entstehenden Reaktionsprodukte stich probenartig oder für Versuchszwecke analysiert werden können. Durch einen gegenüberliegenden Einlaß (14) gelangt das unter Oberdruck stehende CO2vom Druckgenerator (2) in die Reaktions kammer (5). Der Druck wird mittels eines Manometers (15) überwacht. Es versteht sich, daß alle Ein- und Auslasse der Reaktionskammer (5) mit in den Zeichnungen nicht dargestellten, ansteuerbaren Ventilen versehen sind.
In der Reaktionskammer (5) sind Elektroden (6,7) angeordnet, die aus abwechselnd schichtweise übereinanderliegenden RuO2- und TiO2-Schichten bestehen. Es zeigt sich, daß sich solche Mehrschicht-Metalloxidelektroden vorzüglich für die vorliegen den Arbeitsbedingungen eignen, da sie sehr stabil gegen die im Elektrolyten enthaltenen sowie die bei der Elektrolyse ent stehenden chemischen Verbindungen sind und wenig unerwünschte Substanzen adsorbieren. Zudem lagern sie Kohlendioxid mit einer gewünschten Adsorptionsenergie an, die einerseits groß genug ist, um eine ausreichende Ausbeute zu erzielen, und anderer seits klein genug ist, um die Elektrode nicht zu blockieren.
|
|
 
Es werden noch weitere Aufbauten notwendig sein um eine Konvertierung zu erreichen.
Der Grundgedanke scheint aber simpel zu sein.
Das gleiche Verfahren ist auch teilweise geeignet um Instant Methan herzustellen
|
|
|
|
.
|