|
Recherche : Patent zur Herstellung von Methan
Verfahren zur elektrolytischen Herstellung von Methanol und Methan durch Reduktion von Kohlendioxid
DE 4126349 C2
DE19914126349
Jahr : 1999
Quelle:
https://register.dpma.de/DPMAregister/pat/PatSchrifteneinsicht?docId=DE000004126349A1&page=1&dpi=300&lang=de&full=true
unter Google
http://www.google.com/patents/DE4126349C2?cl=de
Erfinder:
Andreas Dr Bandi,
Carl-Udo Dr Maier, Werner H
Prof Dr Ing Bloss
Patent Herstellung Methanol Bandi ZSW
Inhalt lt. Google Patents:
BESCHREIBUNG
Die Erfindung bezieht sich auf ein Elektrolyseverfahren nach dem Oberbegriff des Patentanspruchs 1.
Die begrenzten Vorkommen von fossilen Brennstoffen sowie das durch deren Verbrennung verursachte CO2-Problem (Treibhauseffekt) haben in jüngster Zeit die Suche nach weniger umweltbelastenden, alternativen Energieträgern beträchtlich intensiviert. Eine zentrale Bedeutung kommt hierbei der Nutzung der Sonnenenergie zu. In photovoltaischen Anlagen wird solare Energie in elektrische Energie umgewandelt. Da letztere keine geeignete Form für eine Energiespeicherung darstellt, wird die so erzeugte elektrische Energie vielfach dazu verwendet, durch Elektrolyse von Wasser (H2O), Wasserstoff (H2) zu gewinnen. Der durch Elektrolyse mit solarer Energie gewonnene Wasserstoff ist zwar ein idealer Energieträger aber wegen seiner physikalischen und chemischen Eigenschaften, insbesondere seiner Leichtflüchtigkeit und seiner explosiven Reaktionsfähigkeit mit Luft, treten jedoch technische Schwierigkeiten bei der Lagerung, dem Transport und der Nutzung auf, die u. a. aufwendige Sicherheitsmaßnahmen bedingen. Brennbare Kohlenwasserstoffverbindungen, insbesondere wenn sie unter Normalbedingungen flüssig sind, wie zum Beispiel Methanol (CH3OH), sind vergleichsweise einfacher zu handhaben und eignen sich ebenso gut als Energieträger.
Es ist bekannt, daß durch eine Elektrolyse von CO2 in wäßriger Lösung dieses CO2 elektrochemisch mittels Reduktion des Kohlenstoffs an der Kathode in Kohlen wasserstoffverbindungen, wie zum Beispiel Ameisensäure (HCOOH), Methan (CH4) und Methanol (CH3OH), umgewandelt werden kann. In J. Electrochem. So., Vol. 137, S. 2157, 1990 werden von A. Bandi geeignete Elektrodenmaterialien beschrieben, mit deren Hilfe sich das als flüssiger Brennstoff besonders geeignete Methanol durch Elektrolyse von in Wasser gelöstem Kohlendioxid besonders effizient gewinnen läßt. An sich ist zwar eine solche Synthese unter Reduktion des Kohlenstoffs an der Kathode gegenüber der Bildung von Wasserstoff aus Wasser thermodynamisch bevorzugt, jedoch ist dieser Prozeß unter den bekannten Verfahrensbedingungen kinetisch stark gehemmt und bedarf vergleichsweise hoher Aktivierungsenergien, d. h. hoher Überspannungen. Zudem benachteiligt die geringe CO2-Löslichkeit in Wasser die Umwandlung von CO2 gegenüber der konkurrierenden Wasserstoffentwicklung an der Kathode. Die bekannte elektrolytische Methanolsynthese aus CO2 läßt sich daher nur bei kleinen Stromdichten von ca. 0,06 mA/cm2 bis 0,1 mA/cm2 betreiben, während bei höheren Stromdichten fast ausschließlich HZ-Entwicklung stattfindet. Derartig kleine Stromdichten sind für die großtechnische Anwendung nicht wirtschaftlich.
Der Erfindung liegt als Aufgabe die Schaffung eines Elektrolyseverfahrens der eingangs genannten Art zugrunde, mit dem eine elektrochemische Synthese von Kohlenwasserstoffverbindungen aus CO2 mit höheren Stromdichten und großer Effektivität möglich ist. Zudem soll eine geeignete Vorrichtung zur Durchführung eines solchen Elektrolyseverfahrens geschaffen werden.
Diese Aufgabe wird durch ein Elektrolyseverfahren mit den Merkmalen des Patentanspruchs 1 gelöst.
Aufgrund des besonderen Elektrolyten und der vorgegebenen Arbeitsbedingungen mittels entsprechender Festlegung der physikalischen Parameter Druck und Temperatur für diesen Elektrolyten wird erreicht, daß der im wesentlichen aus CO2 bestehende Elektrolyt sogenanntes superkritisches Verhalten zeigt. Ein superkritisches Verhalten ergibt sich für eine Substanz oberhalb ihres kritischen Punktes, der den Endpunkt der flüssig/ gasförmig-Trennlinie für diese Substanz im Druck/Temperatur-Phasendiagramm darstellt. In dem erfindungsgemäß gewählten Arbeitsbereich für den Elektrolyten besitzen die gelösten Ionen und Moleküle eine hohe Beweglichkeit aufgrund der geringen Viskosität des Kohlendioxids (η = 330 µP). Diese für die Elektrolyse günstige physikalische Eigenschaft sowie die unter diesen Verfahrensbedingungen vorliegende hohe CO2-Konzentration im Elektrolyten ermöglichen hohe, für eine großtechnische Nutzung geeignete Stromdichten von ca. 100 mA/cm2 bis 200 mA/cm2.
Das Beifügen einer wasserstoffhaltigen Substanz, gemäß Anspruch 2 vorzugsweise H2O, HCl oder H2S, in geringer Konzentration gewährleistet ein gerade ausreichendes Angebot an Wasserstoff, ohne daß eine zu hohe Wasserstoffkonzentration die CO2- Umwandlung nennenswert beeinträchtigt und eine relevante H2-Entwicklung einsetzt. Die Beimischung eines Leitsalzes dient der Gewährleistung einer ausreichenden Leitfähigkeit des Elektrolyten. Es ist prinzipiell denkbar, als Leitsalz und als wasserstoffhaltige Substanz nur eine Substanz zu verwenden.
Die Verwendung von Wasser nach Anspruch 2 hat den Vorteil, daß die Löslichkeit von Wasser in superkritischem oder nahezu superkritischem CO2 gerade so hoch ist, daß eine ausreichende, aber nicht zu große Wasserstoffkonzentration für die CO2-Umwandlung zur Verfügung steht. Bei der Zumischung in das superkritische CO2 ergibt sich außerdem eine 50 mal größere Diffusivität von H2O als in flüssigem CO2. Auch dies trägt zu der hohen erreichbaren Elektrolyse-Stromdichte bei. Bei Verwendung von HCl ergibt sich, daß dieses in jeder gewünschten Konzentration im superkritischen CO2 löslich ist.
In weiterer Ausgestaltung der Erfindung dienen spezielle quaternäre Ammoniumsalze gemäß Anspruch 3 oder 4 als Leitsalz. Diese Substanzen sind in festem Zustand ionisch vorhanden, einfach herstellbar, mit CO2 kompatibel und während der Elektrolyse stabil, ohne an chemischen Reaktionen teilzunehmen. Sie besitzen auch eine ausreichende Löslichkeit in superkritischem CO2, so daß sich eine Elektrolytleitfähigkeit bis hin zu Werten von konventionellen wäßrigen Elektrolyten (ungefähr 0,08 Ω-1 cm-1 bei 1 mol/Liter) erreichen läßt.
In Weiterbildung der Erfindung gemäß Anspruch 5 oder 6 bestehen die Elektroden aus leitfähigen Metalloxiden. Solche Elektroden besitzen eine günstige CO2- Adsorptionsfähigkeit, die nicht so klein ist, daß sich nur eine geringe Ausbeute an Syntheseprodukten ergibt, andererseits aber auch nicht so groß ist, daß die Elektroden durch angelagertes CO2 blockiert werden. Gegenüber metallischen Elektroden besitzen derartige Oxidelektroden zudem eine geringere Neigung zur Ansammlung störenden kationischen Materials. Dennoch erweisen sich auch metallische Elektroden nach Anspruch 7 als brauchbar.
Bevorzugt sind die Kontakte der Elektroden an eine photovoltaische Energiegewin nungsanlage angeschlossen, so daß mit der dort in elektrische Energie umgewandelten solaren Energie die CO2-Umwandlung durchführbar ist, wonach die Solarenergie in Form der Syntheseprodukte gespeichert ist.
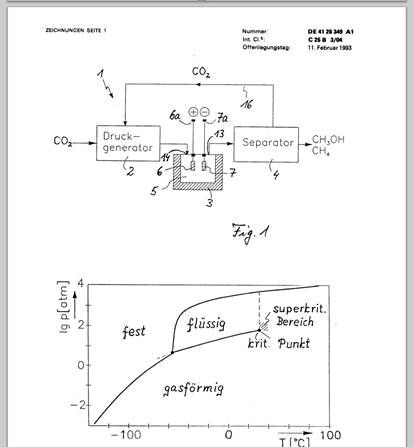
Fig. 1 zeigt schematisch eine Anlage zur Durchführung einer Elektrolyse mit CO2 im superkritischen Bereich als wesentlichen Elektrolytbestandteil,
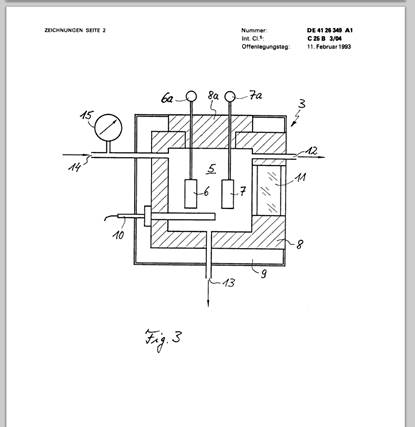
Fig. 2 das Druck/Temperatur-Phasendiagramm von CO2 und
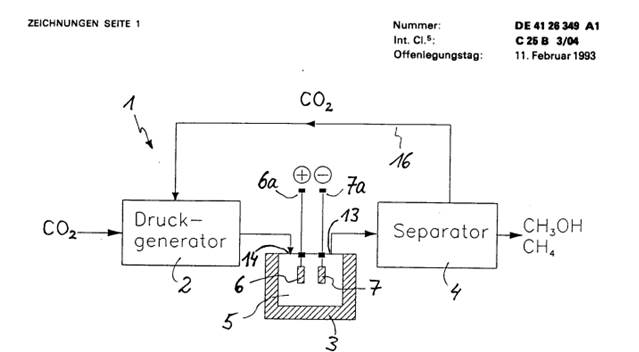
Fig. 3 einen Längsschnitt durch eine Elektrolysezelle, wie sie für die Anlage nach Fig. 1 verwendbar ist.
Die in Fig. 1 dargestellte Elektrolyseanlage (1) besteht im wesentlichen aus einem Druckgenerator (2), einer Elektrolysezelle (3) und einem Separator (4). Der Druckgenerator (2) komprimiert das zugeführte gasförmige Kohlendioxid und führt dieses unter vorgegebenem Druck stehende CO2 einer Reaktionskammer (5) innerhalb der Elektrolysezelle (3) zu. Die auf einer vorgegebenen Temperatur gehaltene Reaktionskammer (5) enthält den Elektrolyten, der im wesentlichen aus CO2 besteht. Druck und Temperatur sind innerhalb der Reaktionskammer (5) so festgelegt, daß sich der Elektrolyt im superkritischen Bereich oder in einem flüssigen Zustand nahe des superkritischen Bereiches befindet.
Dieser superkritische Bereich einer Substanz schließt sich, wie dies in Fig. 2 anhand des Phasendiagramms für reines CO2 gezeigt ist, an den sogenannten kritischen Punkt an, oberhalb dessen eine klare Trennung von gasförmigem und flüssigem Zustand der Substanz nicht mehr gegeben ist und die Substanz mit wachsendem Abstand von diesem kritischen Punkt einem idealen Gas immer ähnlicher wird. Dem Kohlendioxid ist Wasser in einer Konzentration von ca. 0,035 mol/Liter, der Löslichkeitsgrenze unter diesen Bedingungen, beigegeben. Dadurch wird der kritische Punkt gegenüber demjenigen von reinem CO2 geringfügig verschoben. Der kritische Druck des Elektrolyten liegt bei 74 bar, die kritische Temperatur bei 31,5°C. Druck und Temperatur innerhalb der Reaktionskammer werden bevorzugt während der Elektrolyse dicht oberhalb dieser kritischen Werte des Elektrolyten eingestellt.
Zu diesem Zweck muß die Elektrolysezelle ausreichend überdrucksicher aufgebaut sein. In Fig. 3 ist eine Elektrolysezelle (3) dargestellt, wie sie in der in Fig. I nur schematisch dargestellten Anlage verwendbar ist. Sie enthält einen druckfesten Zellenkörper (8) aus rostfreiem Stahl, der die Reaktionskammer (5) umgibt. Dieser Zellenkörper (8) ist seinerseits von einem Flüssigkeitsmantel (9) umgeben, mit dem der Zellenkörper (8) und damit die Reaktionskammer (5) auf der vorgegebenen Arbeitstemperatur gehalten werden. Hierzu wird das im Flüssigkeitsmantel (9) befindliche Medium, z. B. Wasser, auf die gewünschte Temperatur beheizt, wobei zur Regelung der Heizleistung die in der Reaktionskammer (5) herrschende Temperatur mit einer durch den Mantel (9) und den Zellenkörper (8) hindurchgeführten Temperatursonde (10) erfaßt wird. An einer Seitenwand des Zellenkörpers (8) ist zudem ein Fenster (11) angeordnet, durch das die Reaktionskammer (5) optisch überwachbar ist. In derselben Seitenwandung ist in der Nähe der Reaktionskammeroberseite ein Auslaß (12) gebildet, der zu einem Gaschromatograph führt, mittels dem die entstehenden Reaktionsprodukte stichprobenartig oder für Versuchszwecke analysiert werden können. Durch einen gegenüberliegenden Einlaß (14) gelangt das unter Oberdruck stehende CO2 vom Druckgenerator (2) in die Reaktionskammer (5). Der Druck wird mittels eines Manometers (15) überwacht. Es versteht sich, daß alle Ein- und Auslasse der Reaktionskammer (5) mit in den Zeichnungen nicht dargestellten, ansteuerbaren Ventilen versehen sind.
In der Reaktionskammer (5) sind Elektroden (6, 7) angeordnet, die aus abwechselnd schichtweise über einanderliegenden RuO2- und TiO2-Schichten bestehen. Es zeigt sich, daß sich solche Mehrschicht-Metalloxidelektroden vorzüglich für die vorliegenden Arbeitsbedingungen eignen, da sie sehr stabil gegen die im Elektrolyten enthaltenen sowie die bei der Elektrolyse entstehenden chemischen Verbindungen sind und wenig unerwünschte Substanzen adsorbieren. Zudem lagern sie Kohlendioxid mit einer gewünschten Adsorptionsenergie an, die einerseits groß genug ist, um eine ausreichende Ausbeute zu erzielen, und andererseits klein genug ist, um die Elektrode nicht zu blockieren. Von der Anode (6) und der Kathode (7) sind jeweils die entsprechenden Anschlüsse (6a, 7a) aus der Zelle (3) herausgeführt.
Zur Gewährleistung einer ausreichenden Leitfähigkeit ist dem Elektrolyten Morpholinium-Perfluorooktanat als Leitsalz beigefügt, das die Leitfähigkeit des ansonsten kaum leitfähigen superkritischen Kohlendioxids bis auf Werte konventioneller wäßriger Elektrolyten, beispielsweise ca. 0,080 Ω-1 cm-1 bei 1 mol/Liter, anhebt. Auch andere quaternäre, vor allem perfluorierte, Ammoniumsalze sind als Leitsalze geeignet, da sie in superkritischem CO2 hinreichend löslich und mit diesem kompatibel sowie bereits in festem Zustand ionisch vorhanden sind. Außerdem reagieren diese Substanzen nicht mit den übrigen Elektrolytsubstanzen und sind in den Elektrolysebedingungen stabil.
Die erforderliche theoretische Elektrodenspannung für die Elektrolyse ist durch die CO2-Konzentration auch mitbestimmt. Aufgrund der gegenüber wäßrigen Lösungen weitaus höheren CO2-Konzentration ist diese Spannung geringer als in wäßrigen Elektrolyten. Außerdem vermindert die hohe CO2-Konzentration die für die Reaktion benötigte Überspannung. Die wegen der geringen Viskosität von superkritischem oder nahezu superkritischem CO2 hohe CO2-Beweglichkeit und die hohe Diffusivität von H2O unter diesen Bedingungen (ca. 50 mal größer als in normalflüssigem CO2) ermöglichen Stromdichten von 100 mA/cm2 bis 200 mA/cm2, die eine großtechnische Nutzung dieser elektrochemischen Synthese erschließen. Die geringe Wasserkonzentration verhindert eine signifikante Wasserstoffentwicklung. Bei Verwendung des oben angegebenen Elektrodenmaterials wird eine fast 100%ige Effektivität der CO2-Umwandlung in das für Brennstoffzwecke besonders geeignete Methanol erreicht. Geringe Mengen von ebenfalls als Brennstoff verwendbarem Methan (CH4) und unbedeutende Restmengen weiterer Kohlenstoffverbindungen fallen zusätzlich an. Die entstehenden Syntheseprodukte sind schwerer als der Elektrolyt und liegen unter den gewählten Arbeitsbedingungen meist in flüssiger Form vor. Sie reichern sich daher am Boden der Reaktionskammer (5) an. Dort ist, wie aus Fig. 3 zu erkennen, ein Auslaß (13) angeordnet, der zu dem in Fig. 1 schematisch gezeigten Separator (4) führt. Im Separator (4) werden die Syntheseprodukte vom Elektrolyten, d. h. im wesentlichen von CO2, abgetrennt, was dadurch erleichtert wird, daß aufgrund der Anordnung des Auslasses (13) am Kammerboden die Reaktionsprodukte bereits eingangsseitig im Separator (4) in einer höheren Konzentration vorliegen.
Nach Abtrennung der Syntheseprodukte wird das überschüssige gasförmige CO2 vom Separator (4) über eine Rückführungsleitung (16) in den Druckgenerator (2) eingespeist und dort erneut komprimiert.
Die Methanolentstehung basiert auf folgender Reaktion an der Kathode unter Reduktion des Kohlendioxids:
CO2 + 6H3O+ + 6e- → CH3OH + 7H2O,
wobei die Hydroniumionen (H3O+) durch die Anodenreaktion:
9H2O → 3/2O2. + 6H3O+ + 6e-
nachgeliefert werden, so daß sich als Gesamtreaktion:
2H2O + CO2 → CH3OH + 3/2O2
ergibt.
Aus der Bilanzgleichung ist ersichtlich, daß Kohlendioxid und Wasser bei dieser Elektrolyse verbraucht werden. Um einen kontinuierlich ablaufenden Prozeß zu erhalten, werden diese beiden Substanzen laufend nachgeliefert. Für das CO2 geschieht dies, wie oben beschrieben, über den Druckgenerator (2), der gasförmiges CO2 aus einer Flasche sowie das vom Separator (4) zurückgewonnene CO2 komprimiert und der Reaktionskammer (5) über den Einlaß (14) zuführt. Durch Spülen des Kohlendioxids in einem Wasserbad an der Eingangsseite des Druckgenerators (2) werden mit dem CO2 auch H2O-Moleküle entsprechend dem bestehenden Dampfdruck mitgerissen. Diese Menge an Wasser reicht gegebenenfalls bereits zur Gewährleistung der Kontinuität des Prozesses aus. Wenn diese Menge nicht ausreicht, ist es auch möglich, Wasser in nicht gezeigter Weise über einen weiteren Reaktionskammereinlaß getrennt vom CO2 zuzuführen. Zu diesem Zweck ist dann vor diesem Einlaß eine weitere Pumpe angeordnet, welche unter Druck stehendes H2O in die Reaktionskammer einspeist, so daß das Wasser stets in der gewünschten Konzentration in der Reaktionskammer (5) vorliegt. Erleichtert wird die Einstellung der H2O-Konzentration durch die Tatsache, daß eine für den Prozeß günstige Konzentration gerade durch die Löslichkeitsgrenze von H2O in superkritischem CO2 gegeben ist.
Anstatt im superkritischen Bereich des Elektrolyten zu arbeiten, ist es auch möglich, durch geringfügige Unterschreitung der kritischen Temperatur einen gerade noch flüssigen Elektrolyten nahe seines kritischen Punktes zu verwenden, wobei ebenfalls bereits eine hohe CO2-Beweglichkeit, CO2-Konzentration und eine große H2O- Diffusivität vorliegen.
Wichtig sind hier wie immer die Ansprüche
ANSPRÜCHE(7)
- Verfahren zur elektrolytischen Herstellung von Methanol und Methan durch Reduktion, von im Elektrolyten enthaltenen Kohlendioxid (CO2) an der Kathode,
dadurch gekennzeichnet, daß der Elektrolyt im wesentlichen aus CO2, einem beigegebenen Leitsalz und einer beigegebenen wasserstoffhaltigen Substanz besteht, und daß während der Elektrolyse Druck und Temperatur des Elektrolyten wenigstens annähernd so hoch wie die seinem kritischen Punkt entsprechenden Werte gehalten werden.
2. Elektrolyseverfahren nach Anspruch 1, dadurch gekennzeichnet, daß als wasserstoffhaltige Substanz Wasser, Chlorwasserstoff oder Schwefelwasserstoff beigegeben wird.
3. Elektrolyseverfahren nach Anspruch 1 oder 2, dadurch gekennzeichnet, daß als Leitsalz ein quaternäres Ammoniumsalz beigegeben wird.
4. Elektrolyseverfahren nach Anspruch 3, dadurch gekennzeichnet, daß als Leitsalz ein perfluoriertes quaternäres Ammoniumsalz, insbesondere Morpholinium-Perfluorooktanat, beigegeben wird.
5. Elektrolyseverfahren nach einem der Ansprüche 1 bis 4, dadurch gekennzeichnet, daß Elektroden aus leitfähigen Metalloxidverbindungen verwendet werden.
6. Elektrolyseverfahren nach Anspruch 5, dadurch gekennzeichnet, daß aus mehreren alternierend aufeinandergeschichteten Metalloxidschichten, insbesondere RuO2 und TiO2, bestehende Elektroden verwendet werden.
7. Elektrolyseverfahren nach einem der Ansprüche 1 bis 4, dadurch gekennzeichnet, daß Elektroden aus Metallen, insbesondere Ni, Cu, Ag oder Au, oder aus Legierungen dieser Metalle verwendet werden
|
|
|
|
.
|