Erste Ionisierungsenergie
F= (kc* (ze*e))/r2
Coulomb-Konstante kc=1/(4 Pi e0)
Hier ist auch die Basis der Bedeutung von Coulomb beinhaltet: die Energie der Ladung
Quelle: Wikipedia
https://de.wikipedia.org/wiki/Ionisierungsenergie
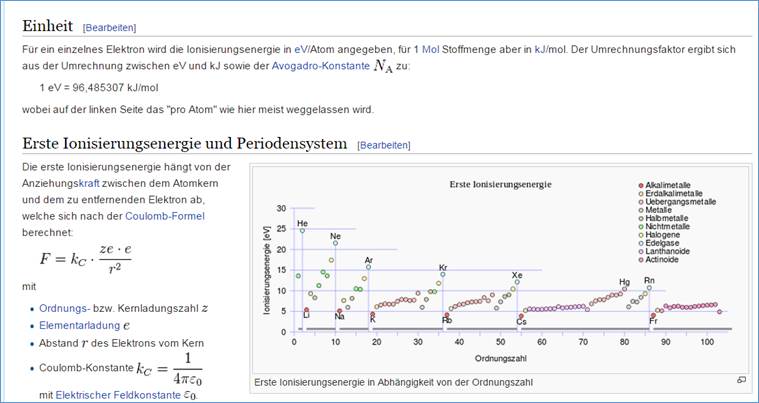
Zu beachten ist, dass die Ionisierungsenergie mit zunehmender Elektronenzahl in der Periode zunimmt.
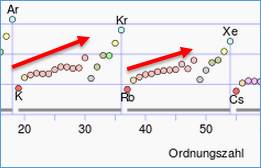
Je mehr Schalen das Atommodell allerdings hat, desto geringer ist die Ionisierungsenergie, da der Abstand zum Atomkern steigt
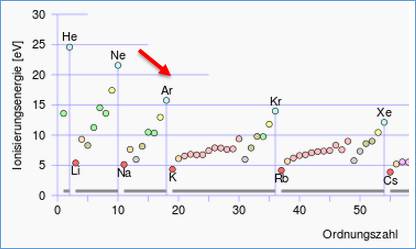
In ChemGlobe wid das Schalenmodel mit angezeigt
Quelle:
http://chemglobe.org/general/atomeigenschaften/ionisierung.php
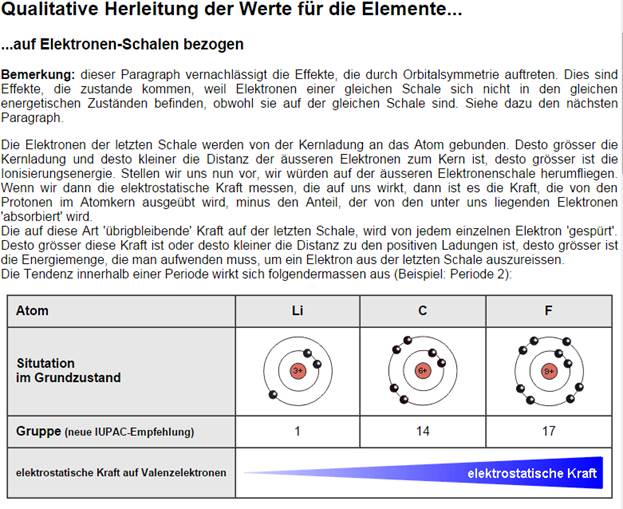
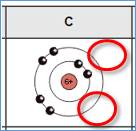
Hier lohnt sich ein genauerer Blick auf bestimmte Stoffe in unserem Alltag: Kohlenstoff
Kohlenstoff hat 6 Elektronen und zugehörige Kerne
Und belegt wie oben gezeigt die äußere Schale nicht vollständig, woduch meistens 4-er Bindungen eingegangen werden
 http://www.periodensystem.info/elemente/kohlenstoff/
http://www.periodensystem.info/elemente/kohlenstoff/
Atomradius (empirisch):
|
70 pm
|
Atomradius (errechnet):
|
67 pm
|
Kovalenter Radius:
|
77 pm
|
Van-der-Waals-Radius:
|
170 pm
|
Atomvolumen:
|
5,30 cm3/mol
|
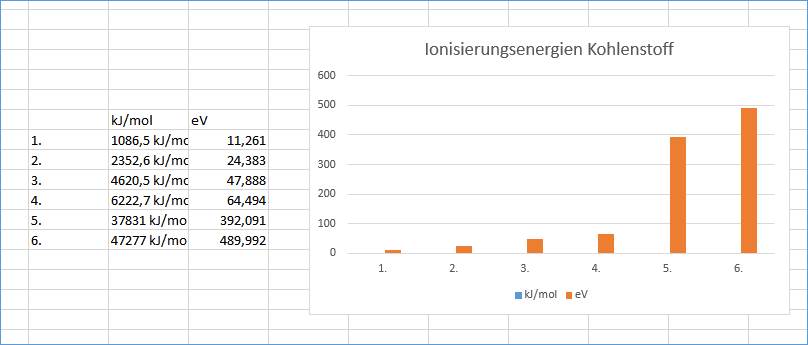
Ionisierungsenergien:
|
|
kJ/mol
|
eV
|
|
1.
|
1086,5 kJ/mol
|
11,261
|
|
2.
|
2352,6 kJ/mol
|
24,383
|
|
3.
|
4620,5 kJ/mol
|
47,888
|
|
4.
|
6222,7 kJ/mol
|
64,494
|
|
5.
|
37831 kJ/mol
|
392,091
|
|
6.
|
47277 kJ/mol
|
489,992
|
|
|
|
Oxidationszahlen:
|
IV, II,-IV
(wichtigste in fett hervorgehoben)
|
Elektronegativität (Pauling):
|
2,55
|
Elektronegativität (Allred/Rochow):
|
2,5
|
Ionenradius:
|
15 pm
|